首頁(yè)

金斯瑞cGMP生產(chǎn)平臺(tái)聚焦于提供可靠的一站式服務(wù),涵蓋了早期的多肽藥物開(kāi)發(fā)、IND申報(bào)、臨床試驗(yàn)。我們?yōu)榭蛻袅可矶ㄖ平鉀Q方案,滿足客戶的特殊需求。我們專業(yè)的藥政事務(wù)團(tuán)隊(duì)致力于為多肽藥物的CMC文件和全球監(jiān)管策略提供全面支持。
20+年專業(yè)經(jīng)驗(yàn)
cGMP合規(guī)性
法規(guī)支持

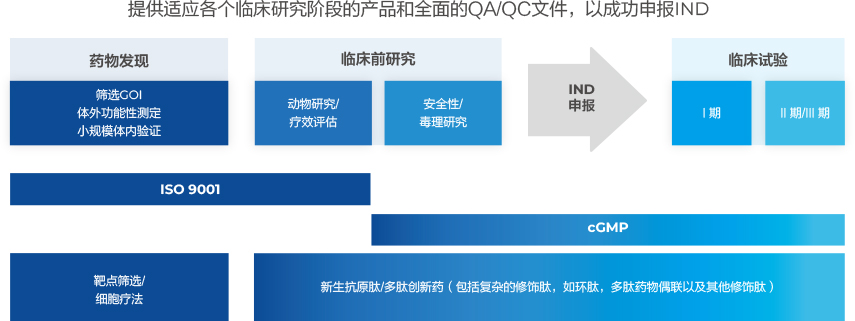
提供滿足IND申報(bào)的API生產(chǎn)工藝開(kāi)發(fā)的一站式服務(wù)
潔凈區(qū)配備A級(jí)無(wú)菌隔離器,可以提供無(wú)菌多肽
提供適用于新生抗原肽的無(wú)菌過(guò)濾和無(wú)菌灌裝服務(wù)
提供工藝開(kāi)發(fā)和工藝放大的服務(wù)
提供新生抗原肽快速生產(chǎn)、檢測(cè)、放行服務(wù),最多每個(gè)批次48條個(gè)性化新生抗原序列
復(fù)雜序列和多種多肽修飾可以提供大規(guī)模生產(chǎn)服務(wù),包括環(huán)肽和多肽藥物偶聯(lián)物。

完整的批生產(chǎn)記錄
質(zhì)量標(biāo)準(zhǔn)包含鑒別 、純度、微生物限度、內(nèi)毒素等項(xiàng)目
完善的物料供應(yīng)商管理體系
分析方法開(kāi)發(fā)、確認(rèn)、驗(yàn)證服務(wù)
符合ICH要求的長(zhǎng)期和加速穩(wěn)定性測(cè)試,強(qiáng)降解研究
完善的質(zhì)量管理系統(tǒng): 滿足ICH Q7A和藥品生產(chǎn)質(zhì)量管理規(guī)范
TSE/BSE聲明
金斯瑞專業(yè)的生產(chǎn)能力,快速交付能力以及平臺(tái)工藝可以為您解決新生抗原肽以及多肽原料藥從早期藥物開(kāi)發(fā)到臨床I/II期的研究。我們的GMP廠房以及一站式服務(wù),可以靈活支持您各個(gè)階段的研究項(xiàng)目。