行業(yè)洞見
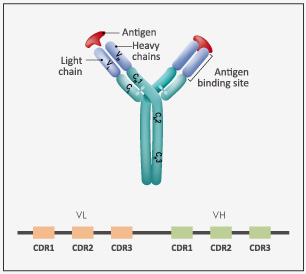
獲批抗體藥及適應(yīng)癥
1986年美國FDA批準第一款單克隆抗體藥物-單抗OKT3,至今已經(jīng)近百款抗體藥物獲得FDA的批準上市。近年來,在FDA每年批準的新藥中,抗體藥物占據(jù)了約1/5的份額。這些款抗體藥物對應(yīng)的適應(yīng)癥中,腫瘤治療仍是主流,其次是皮膚科和血液疾病。商業(yè)化抗體產(chǎn)品表現(xiàn)出靶點相對集中,居第一的是PD-1/L1,緊隨其后是CD20、TNF、HER2等熱門靶點。

新藥研發(fā)現(xiàn)狀
藥物研發(fā)的主要有三大特點:
- 耗時長
- 成功率低
- 投入高
新藥從研發(fā)到上市的全流程需要約10年時間,花費近10億美元。據(jù)數(shù)據(jù)統(tǒng)計,僅約12%的臨床試驗項目能夠最終獲批FDA。同商業(yè)化抗體產(chǎn)品類似,新藥研發(fā)階段也顯示同一問題,即靶點相對集中。

抗體藥物未來發(fā)展
隨著抗體技術(shù)得到不斷更新,基于單克隆抗體衍生了越來越多的抗體藥物,例如ADC、雙抗、抗體片段、以及納米抗體等等。全球范圍內(nèi)已上市的雙抗有四種,ADC藥物有14款。國內(nèi)不少企業(yè)開始入局新型抗體藥物研發(fā)賽道,隨著抗體藥物的發(fā)展,抗體藥物的審批速度也將越來越快,未來將看到大批抗體藥物集中上市。
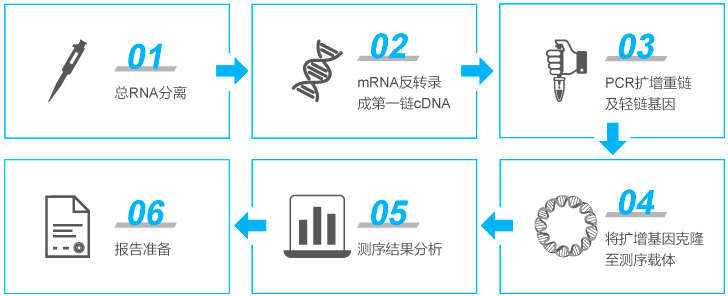
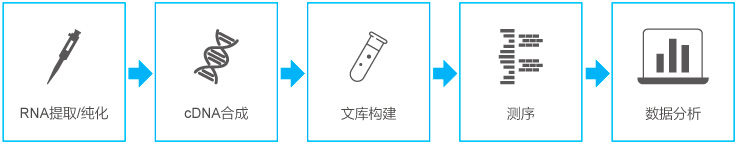
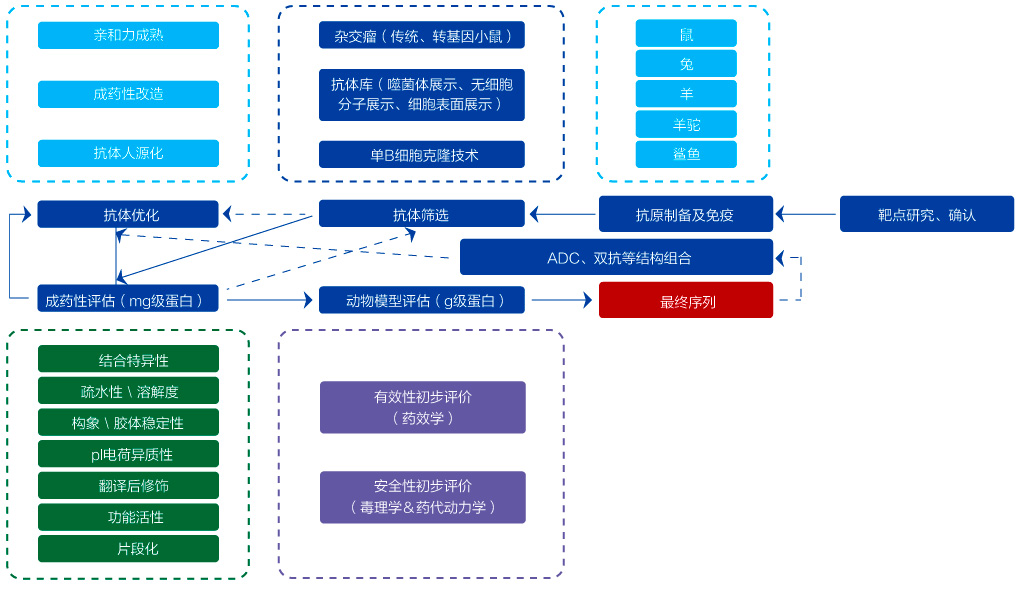
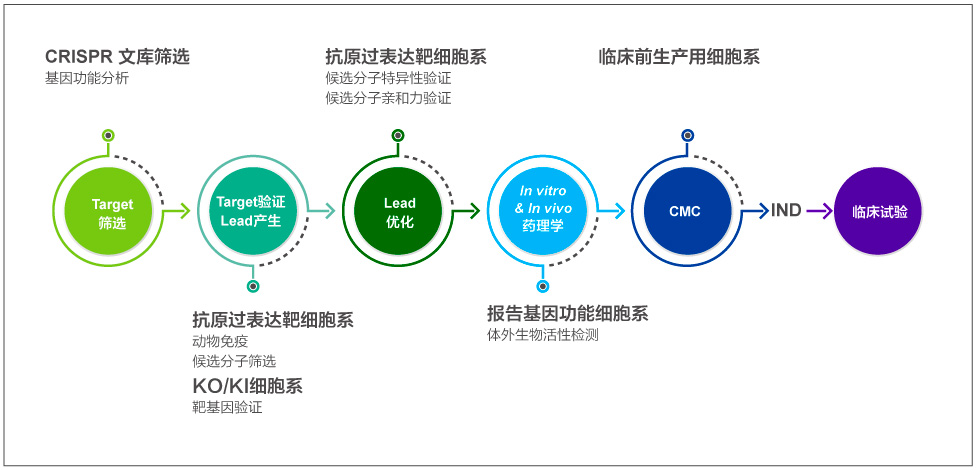
抗體藥研究階段開發(fā)流程
生物醫(yī)藥從業(yè)者面臨的問題
-

靶點發(fā)現(xiàn)與轉(zhuǎn)化率低
-

藥物研發(fā)投入與風(fēng)險控制壓力大
-

候選藥物安全性與效力預(yù)測失敗率高
-

藥物開發(fā)項目決策難
金斯瑞建立了從高通量靶點篩選、抗原和抗體制備、細胞系開發(fā)、高通量表達等一系列技術(shù)平臺,提供從靶點發(fā)現(xiàn)、先導(dǎo)抗體產(chǎn)生和優(yōu)化、功能鑒定與分析等解決方案,匹配不同階段需求,為生物藥研發(fā)提供加速動力。
靶點發(fā)現(xiàn)
藥物靶點的篩選是藥物開發(fā)過程中的重要環(huán)節(jié),靶點篩選的成功與否直接影響到后期藥物的相關(guān)研究,采取何種靶點篩選策略成為研發(fā)人員關(guān)注的焦點。在靶點發(fā)現(xiàn)過程中,往往需要解決以下問題:靶點分子與上下游通路的作用機制;靶點分子相關(guān)基因與轉(zhuǎn)錄水平特征的分析;在獲得抗原蛋白的過程中,如何克服難度蛋白的制備問題。金斯瑞技術(shù)平臺可以提供從分子基因的表達質(zhì)粒構(gòu)建到高通量文庫篩選方案,以及靶分子制備的定制方案,幫助全球科學(xué)家快速推進靶點發(fā)現(xiàn)進程。
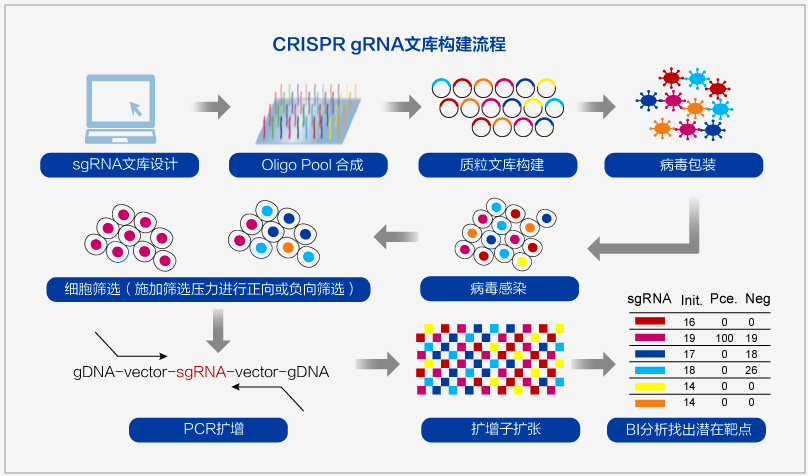
高通量靶點篩選-gRNA文庫
金斯瑞基于CRISPR技術(shù)和oligo pool開發(fā)出全基因組 gRNA文庫,用于高通量基因編輯,實現(xiàn)高通量的靶點篩選或功能性基因篩選。
金斯瑞案例:
訂單: 12,000條核苷酸序列的引物池,長度125mer
金斯瑞方案: 12K芯片,半導(dǎo)體技術(shù)合成,一周內(nèi)交付,合成后小量擴增
QC檢測: NGS測序
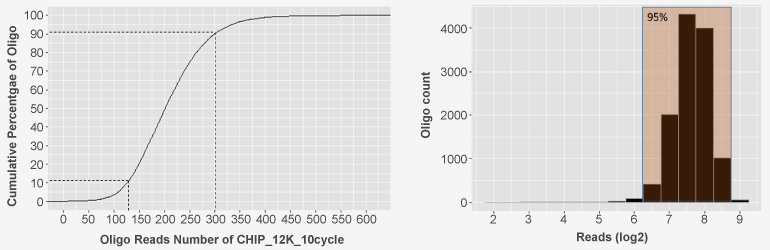
檢測結(jié)果:
-

12,000條自定義Oligo均勻分布
-

99.74%覆蓋率

0.27%堿基錯誤率

均一度:90% / 10% < 2.5
金斯瑞現(xiàn)貨供應(yīng),針對Human和Mouse全基因組范圍的CRISPR基因敲除(GeCKO)gRNA文庫和轉(zhuǎn)錄激活(SAM)gRNA文庫,實現(xiàn)全基因范圍內(nèi)功能基因的高通量快速篩選。同時金斯瑞還可以按照需求為客戶合成由Broad研究所預(yù)先設(shè)計和驗證的gRNA序列,基因靶點由藥物基因交互數(shù)據(jù)庫確定,靶向篩選特定通路的Pathway-focused gRNA文庫 。
先導(dǎo)抗體產(chǎn)生
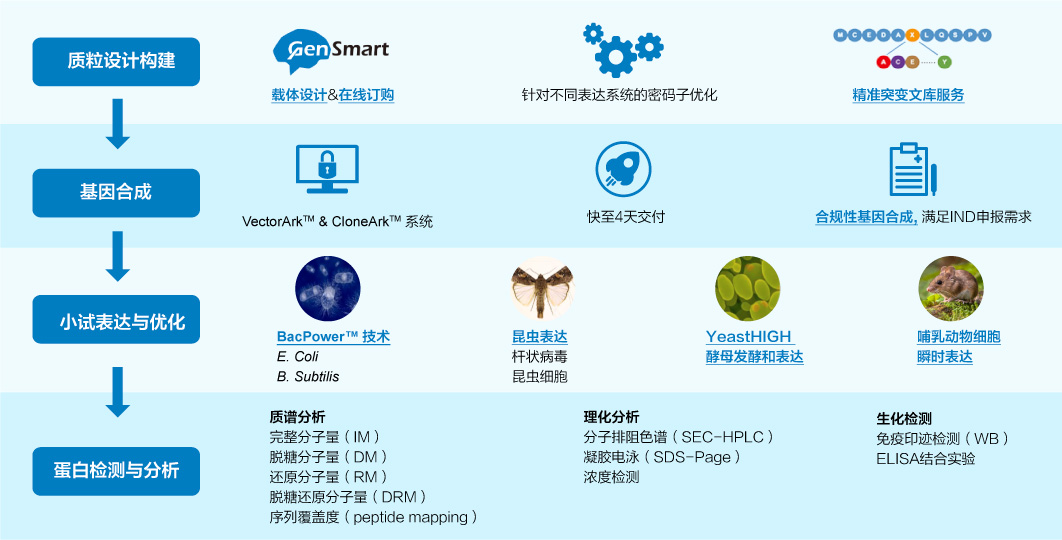
當(dāng)靶點確認后,生物藥研發(fā)項目進入到先導(dǎo)抗體產(chǎn)生階段。金斯瑞提供從多肽、蛋白分子等抗原制備、動物免疫及篩選到抗體表達純化等一站式先導(dǎo)抗體生產(chǎn)。
抗原制備
金斯瑞擁有超19年多肽合成和蛋白表達經(jīng)驗,根據(jù)項目需求提供定制化抗原制備,完善的質(zhì)控體系,快速交付。
靶蛋白制備流程
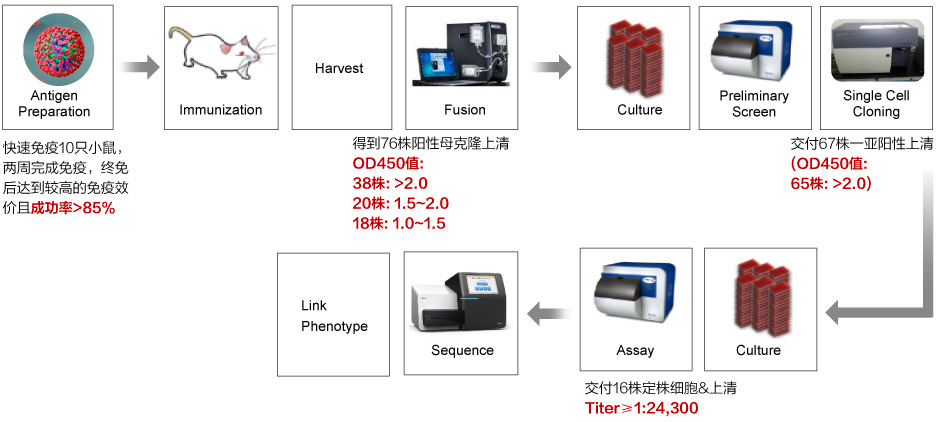
動物免疫及篩選
三大抗體開發(fā)平臺-鼠雜交瘤平臺、兔B細胞克隆平臺及單B細胞篩選平臺
| 鼠雜交瘤平臺 | 兔B細胞克隆平臺 | 單B細胞篩選平臺 | |
|---|---|---|---|
| 抗體來源 | 脾細胞 | 記憶B細胞 | 記憶B細胞 |
| 克隆數(shù) | ≤ 20個克隆 | 50 - 100 個克隆 | > 100 個克隆 |
| 多樣性 | 中等 | 高 | 較高 |
| 特點 |
|
|
|
金斯瑞案例:
-

雜交瘤技術(shù)平臺
-

B細胞克隆技術(shù)平臺
案例1:在新冠抗體開發(fā)中,兔單抗平臺能高效獲得陽性克隆
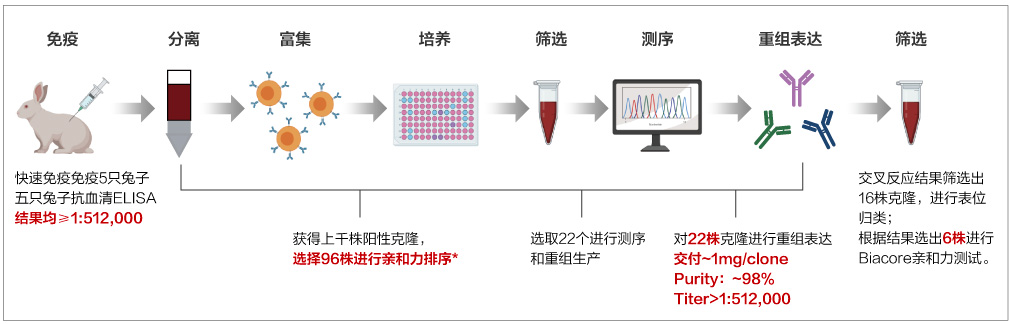
案例2:兔單抗高效制備具有交叉識別能力的抗體
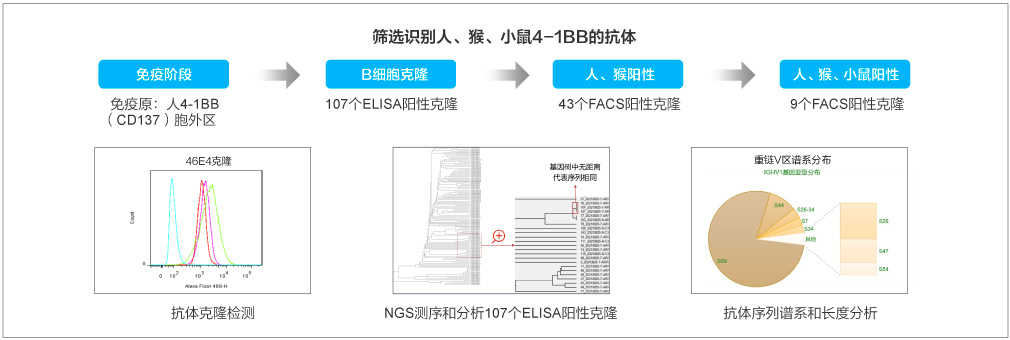
結(jié)果:篩選方案為4-1BB胞外區(qū)ELISA+細胞ELISA+FACS,測序與重組表達驗證,重組陽性率33/43=76.7%。
-

Beacon?平臺高通量自動化細胞篩選
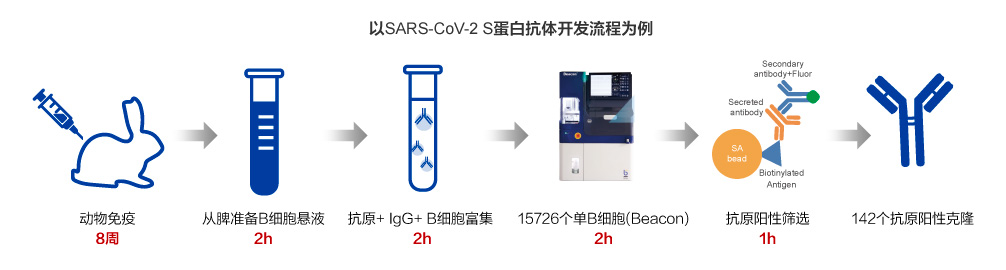
抗體測序
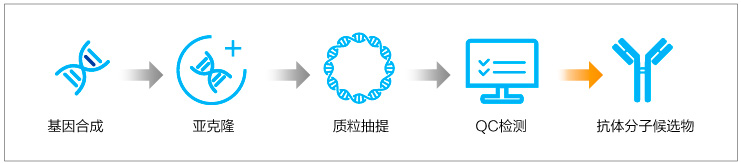
快速篩選-Gene to Plasmid
無論是雜交瘤平臺還是B細胞克隆技術(shù),最終獲得的候選分子序列需要進行重組抗體的表達與制備,進一步篩選和驗證。如何進行經(jīng)濟高效地構(gòu)建表達質(zhì)粒是生物藥研發(fā)過程必須解決的問題,金斯瑞Gene to plasmid服務(wù)幫助研究者更快速經(jīng)濟地篩選表達抗體。金斯瑞Gene to Plasmid服務(wù)快至7天交付,相比常規(guī)基因合成+質(zhì)粒服務(wù)業(yè)務(wù)周期縮短一倍,快人一步、領(lǐng)先一路!
-

快速交付
短至7天 -

免費建立
獨立載體庫 -

高通量平臺
穩(wěn)定交付 -

信息安全
IP保護
先導(dǎo)抗體優(yōu)化
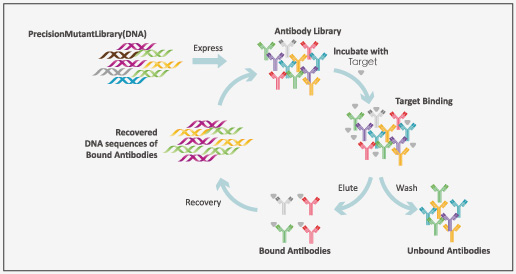
高通量、快速篩選親和力成熟抗體-精準突變文庫
從天然抗體庫中篩選得到的抗體通常親和力較低,不足以滿足治療性需要。研究人員在得到候選分子后,通常需要對先導(dǎo)抗體進行優(yōu)化和改造,包括人源化、嵌合,序列定向進化等,較大程度提高抗體的親和力,降低異源免疫原性,提高抗體的穩(wěn)定性和安全性等。
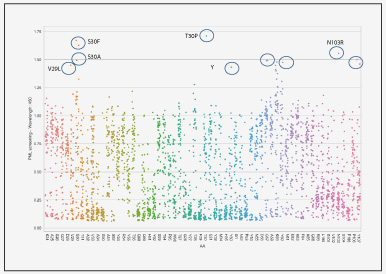
針對目標抗體的輕鏈和重鏈的靶向CDR區(qū)域,金斯瑞提供完整的突變文庫用于親和力成熟。在金斯瑞以往案例中,重鏈和輕鏈上6個CDR區(qū)共包含63個突變位點,通過精準掃描飽和突變將每個野生型的氨基酸密碼子突變?yōu)槠渌?9種氨基酸的密碼子,得到多個高親和力突變體,其中最高可達4個數(shù)量級。不同階段利用不同類型的精準突變文庫能夠高效提升抗體親和力成熟。
更多文庫信息>>>
高通量抗體瞬時表達
在候選抗體優(yōu)化過程中,需要同時表達多個候選抗體進行多次驗證。依托金斯瑞高通量基因合成服務(wù)和高效的瞬時抗體表達技術(shù),金斯瑞高通量重組抗體表達平臺 ,從基因合成至蛋白或抗體,快至6個工作日交付,且三重QC檢測保證交付質(zhì)量!項目流程經(jīng)二維碼監(jiān)控,全程可追溯,并且在生物安全法出臺的情況下,金斯瑞可提供更規(guī)范和全面的材料支持,為下游研發(fā)提供全面的支持。
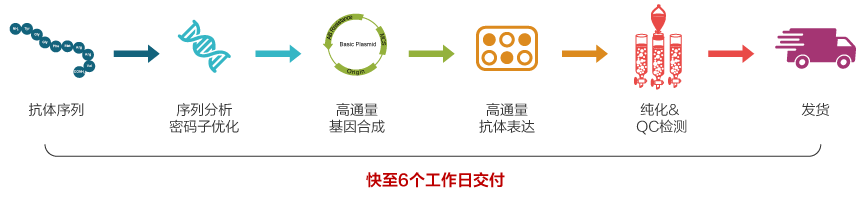
金斯瑞案例:
Covid-19 相關(guān)抗體篩選
表達體系:4ml,序列數(shù)量:40個
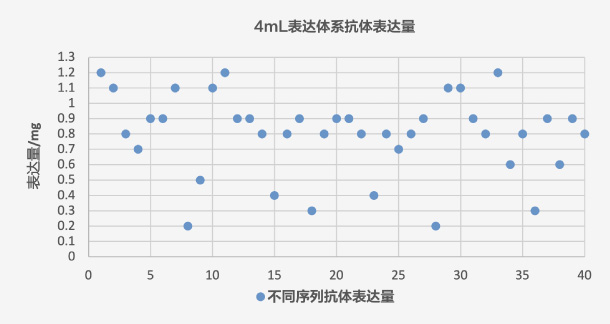
結(jié)果:
抗體藥研究階段開發(fā)流程~65% 的序列表達量≥200mg/L,個別序列表達量偏低,滿足客戶篩選要求
抗體穩(wěn)定表達- 細胞系服務(wù)
在獲得候選克隆之后,通常需要構(gòu)建穩(wěn)定細胞系,這是抗體藥物研發(fā)過程中一個必不可少的工作。金斯瑞細胞系開發(fā)服務(wù)包括組成型過表達、誘導(dǎo)型過表達和報告細胞系,金斯瑞技術(shù)團隊擁有250+靶細胞經(jīng)驗,提供多種轉(zhuǎn)染或感染方式及檢測方法,滿足客戶不同階段項目需求。

功能驗證與分析
在生物藥物的臨床前研發(fā)中,一旦確定抗體藥物的分子形式并在哺乳動物細胞中表達出抗體蛋白分子后,需要對得到的抗體進行功能驗證、成藥性評估(mg級抗體)、動物模型評估(g級抗體)等一系列分析。這些所有的功能驗證與分析均需要大量的抗體,那如何獲得足夠的接近天然狀態(tài)的抗體?金斯瑞提供基于CHO表達系統(tǒng)的克級抗體表達。
克級抗體瞬時表達-CHO表達平臺
哺乳動物細胞表達系統(tǒng)對于翻譯后修飾和折疊蛋白的表達至關(guān)重要,CHO細胞是常見的表達重組抗體/蛋白的宿主細胞,金斯瑞CHO細胞瞬時轉(zhuǎn)染平臺提供40mL-200L表達體系,快至3周交付克級抗體分子。
-

CHO表達系統(tǒng)
商業(yè)化生產(chǎn)細胞系
一致性好 
周期短
快至3周,交付克級抗體分子
40~200L表達體系靈活選擇
嚴格質(zhì)控
業(yè)內(nèi)高質(zhì)量抗體交付
全程樣品唯一二維碼追溯,零錯誤
高表達量
常規(guī)抗體平均表達量達400mg/mL
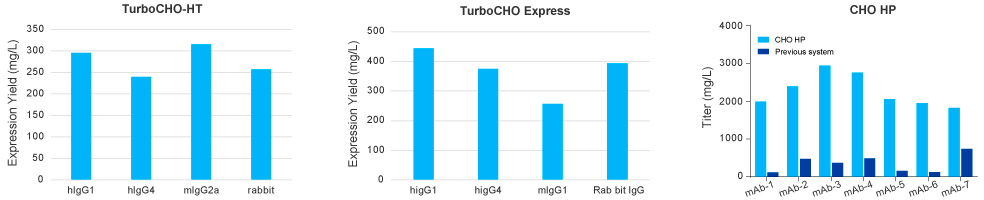
金斯瑞案例:

案例1:不同抗體類型在CHO-HT,CHO Express和CHO HP表達量統(tǒng)計
案例2:不同抗體類型在CHO平臺表達情況
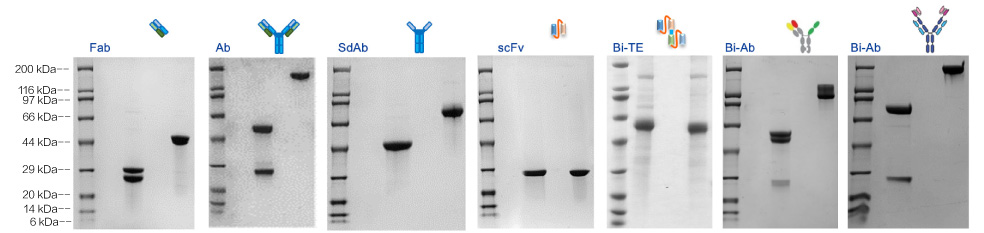
結(jié)果:
CHO-Express平均表達量為544mg/mL,超過88%的項目的表達量≥200mg/mL
靶點驗證、體外活性-細胞系服務(wù)
基于CRISPR技術(shù)的細胞系在靶點發(fā)現(xiàn)階段可根據(jù)細胞表型的變化,確定作用靶點或者制備膜蛋白靶點的細胞用于抗體藥的篩選。在獲得靶點后,可以利用細胞系進行功能分析得到Leads。體內(nèi)外的藥理學(xué)分析過程中,細胞系可以用于藥物功能的驗證。總之,基于CRISPR的細胞系服務(wù)貫穿于抗體藥研發(fā)的始終,是抗體藥開發(fā)的強有利工具。
合規(guī)性服務(wù)
為了滿足客戶臨床申報合規(guī)性的需求,金斯瑞推出了合規(guī)性基因合成服務(wù),該服務(wù)支持藥物生產(chǎn)企業(yè)對研發(fā)階段的基因質(zhì)粒的生產(chǎn)制備數(shù)據(jù)進行溯源,提供相關(guān)的完善試驗記錄與材料,獨立的質(zhì)量管理體系和內(nèi)部生產(chǎn)流程,同時配合現(xiàn)場審核。金斯瑞逐步將合規(guī)性基因合成擴展到克隆/質(zhì)粒抽提和申報級測序等合規(guī)性服務(wù)。